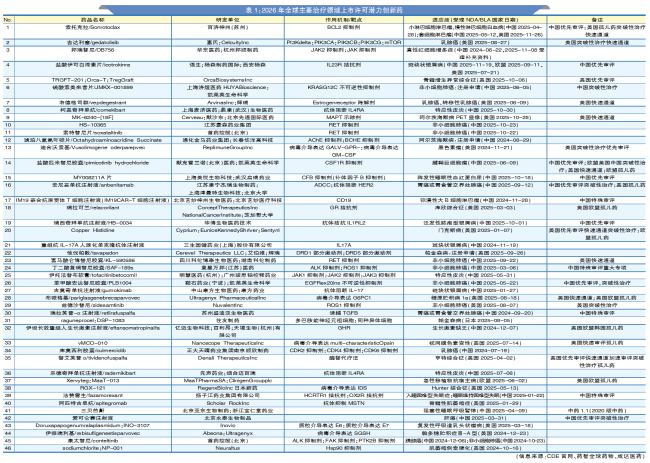
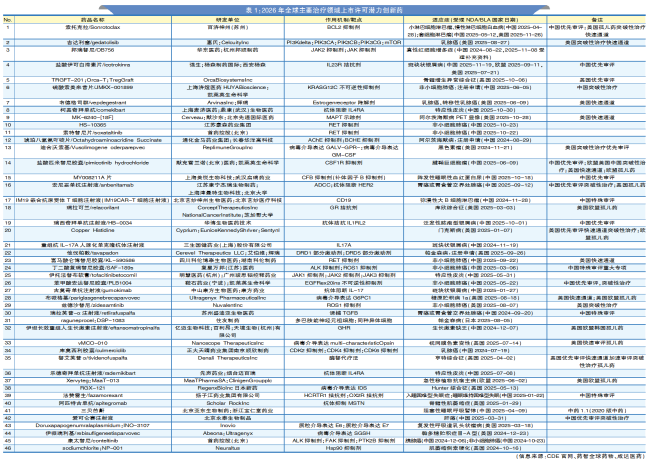
2026年,一批创新药已进入研发最后阶段,接近审批冲刺期,有望获批上市许可。本文对肿瘤、自身免疫、神经系统及罕见病四大领域的重点品种进行系统梳理与深度分析,揭示其背后的研发逻辑与潜在临床影响。
文末一表速览2024—2025年已递交新药上市许可申请(NDA)或生物制品上市许可申请(BLA)的品种(不完全统计,详见表1),今年获批潜力巨大!
肿瘤治疗 破局耐药 重塑模式
肿瘤药物研发已进入深水区,其前沿指向有两个不容忽视的方向:一是通过更精准的靶向设计来克服或规避现有疗法的耐药问题或体现临床差异化优势;二是利用细胞工程等新技术,从根本上重塑治疗过程,以达成更优的疗效与安全性平衡。
以非小细胞肺癌(NSCLC)为例,兹德沙替尼已在实验室中显示出对多种ROS1融合蛋白及耐药性突变的有效性,拟用于那些已经尝试过至少两种ROS1酪氨酸激酶抑制剂(TKI),但疾病仍然进展的转移性ROS1阳性NSCLC患者,尤其是对现有ROS1抑制剂耐药的患者。在竞争已十分激烈的KRASG12C赛道,硫酸索美来昔的差异化策略基于其临床前数据,强调了两个可能决定临床成败的关键特性:较强的脑通透性(对于易发生脑转移的肺癌至关重要)以及未见心脏毒性和药物相互作用风险(关乎长期用药安全与联合治疗潜力),这为其在同类药物中脱颖而出创造了条件。
在乳腺癌领域,克服内分泌治疗耐药是核心命题。正大天晴的库莫西利是一种新型的CDK2/4/6抑制剂,其增强的CDK2抑制活性被寄望于逆转现有CDK4/6抑制剂的耐药。更值得关注的是其开发策略:相继成功递交用于二线及一线治疗的NDA,验证了该药物在晚期乳腺癌不同治疗阶段的应用潜力。吉达利塞作为一款PI3K/mTORC1/2广谱抑制剂,其提交NDA所依据的VIKTORIA-1临床试验数据极具说服力。在PIK3CA野生型患者中,其联合方案中位无进展生存期达到9.3个月,而对照组仅为2.0个月;疾病进展风险降低76%。
此外,盐酸匹米替尼的成功开发则体现了对高度未满足需求的专注。针对腱鞘巨细胞瘤,其在中、美、欧三地均获得“突破性治疗”或“优先药品”等审评加速资格,说明了全球监管机构对该药物临床价值的认可。
CGT疗法以TRGFT-201为代表,这是一种工程化的供体来源的骨髓移植物,去除了T细胞并富含调节性T细胞(Tregs)和效应T细胞的最佳混合物。美国FDA于2025年10月6日受理其在研同种异体T细胞免疫疗法的BLA并授予优先审评(PriorityReview)资格,用于治疗包括急性髓系白血病(AML)、急性淋巴细胞白血病(ALL)和骨髓增生异常综合征(MDS)在内的血液恶性肿瘤。关键Ⅲ期数据显示,TRGFT-201在无中重度慢性移植物抗宿主病(cGvHD)生存率方面相较传统移植具有统计学显著且临床意义的改善。
自免疾病 疗法迭代 提升体验
自免疾病发病机制复杂,导致新药研发失败率极高。近年来频发药物研发终止事件,原因多为疗效不足。该领域的竞争聚焦对长期治疗体验的全面优化。
1.给药途径从注射到口服
伊可白滞素是一种靶向IL-23受体的口服环肽类药物。其潜在革命性在于其口服给药方式,达到注射才能实现的抗炎效果。我国CDE已将该创新药纳入优先审评。盐酸伊可白滞素片拟用于斑块状银屑病的适应症的NDA在美国(2025-07-21)、欧盟(2025-09-11)、中国(2025-11-19)已获得受理。
2.给药周期的优化与靶点机制的深化
在特应性皮炎等慢性病领域,延长给药间隔是明确的研发趋势。柯美奇拜单抗的设计亮点即在于其长效性,有望将抗IL-4Rα单抗的给药频率从现有的2周一次延长至4周一次,直接提升患者生活质量。而乐德奇拜单抗同样靶向IL-4Rα,其临床特点在于起效更快,并可能拥有更高的临床应答。此外,乐德奇拜单抗在研的还有多项适应症,如哮喘、慢性阻塞性肺病、慢性鼻窦炎伴鼻息肉等。
MY008211A是一种补体B因子(CFB)抑制剂。CFB是补体旁路途径(AP)的正向调节因子,MY008211A通过特异性结合B因子,抑制补体旁路途径中CFB的活性,抑制AP和AP通路中的正反馈放大环路,从而抑制C3和C5转化酶的形成,最终改善血管内溶血,无血管外溶血风险。MY008211A为化药1类创新药。在我国,武汉启瑞药业有限公司已递交MY008211A片用于阵发性睡眠性血红蛋白尿(PNH)的NDA并于2025年10月18日获得受理。
邦瑞替尼是由杭州华东医药集团生物医药有限公司、杭州邦顺制药有限公司研发的化药1类创新药,用于真性红细胞增多症的NDA于2024年8月22日在国内受理,2025年11月8日补充资料的审评获得受理。
神经系统疾病 构建体系 修正策略
面对神经退行性疾病,近期的进展显示出清晰的“两条腿走路”策略:一是发展高灵敏度的生物标志物检测技术,实现早诊早治;二是开发能触及疾病核心病理的疗法,而非仅仅控制症状。
1.阿尔茨海默病(AD)的诊疗协同突破
诊断端的进步是实施精准治疗的前提。tau蛋白示踪剂MK-6240-[18F]能够在活体内对AD的关键病理标志——tau蛋白神经原纤维缠结进行可视化、定量化评估。这不仅助力早期诊断和鉴别诊断,更能动态监测疾病进展和治疗效果,为临床试验和新药评估提供关键工具。在治疗端,琥珀八氢氨吖啶作为拥有双重胆碱酯酶抑制功能的新药,其Ⅲ期临床试验达到主要终点,且报告的不良事件发生率低于对照组,为症状管理提供了新的有效武器。
2.帕金森病的多维度干预与本源疗法探索
帕金森病的药物研发正超越单纯的多巴胺替代。他伐帕敦是第一个也是唯一一个正在研究的D1/D5部分激动剂,可能带来更好的运动症状控制和更低的副作用风险。更具颠覆性潜力的是细胞疗法Raguneprocel,住友制药株式会社已于2025年8月5日提交该细胞产品的制造与上市许可申请,该产品可改善晚期帕金森病患者在“关闭”期的运动功能。本次提交上市申请的依据,来源于京都大学医院所开展的研究者发起临床试验数据,该试验结果已于2025年4月发表在《自然》杂志。
此外,在失眠领域,法赞雷生作为食欲素受体拮抗剂,其Ⅲ期临床试验数据显示了快速、持久的疗效,且因不良事件终止治疗率极低(0.6%),无戒断症状,体现了其在疗效与安全性间良好的平衡。
罕见病领域 填补空白 优化标准
1.疗效“前所未有”刷新期待
Xervyteg在治疗伴有胃肠道受累的急性移植物抗宿主病(GI-aGvHD)患者的Ⅲ期临床试验ARES中达到主要终点。对类固醇治疗无应答且对鲁索替尼(ruxolitinib)耐药或不耐受患者,其三线治疗的客观缓解率达到62%,远超过预期目标。有望重新定义治疗标准。
2.以患者为中心的长期管理方案优化
在儿童生长激素缺乏症领域,治疗依从性是影响疗效的核心因素。伊坦长效重组人生长激素的核心价值在于其将每日一次的皮下注射改为每周一次。其Ⅲ期研究确证了这种给药方式在促进身高生长方面的非劣效性。亿迈生物科技(香港)有限公司、百利昂意大利有限公司和天境生物(杭州)有限公司联合在我国递交伊坦长效重组人生长激素注射的NDA并于2024年12月7日获得受理。